第25回山梨科学アカデミー賞・奨励賞表彰式が、11月16日(月)にベルクラシック甲府で開催され、地域社会システム学科の菊地淑人准教授の研究が、山梨科学アカデミー奨励賞を受賞しました。同賞は、学術研究、技術開発及び教育等の分野において優れた成果を収め将来を嘱望される、山梨県に関わりを有する個人又はグループに対して贈られるものです。
受賞テーマは「「文化的景観」の価値及び活用手法に関する研究」です。人と自然のかかわりのなかで育まれてきた景観(文化的景観)の価値評価や活用手法等に関するこれまで進めてきた調査研究の成果や地域への貢献が評価されたものです。
受賞した菊地准教授は、「今回はこのような賞を頂戴することができ、大変うれしく思っております。今回の受賞を糧として、今後も歴史文化を活かした持続可能な地域づくり、観光地形成等に資する調査研究を重ねてまいりたいと考えています。」と話しています。

受賞した菊地淑人准教授(中央)

表彰状及びメダル
地域食物科学科(ワイン科学研究センター)の榎真一助教と東京農業大学生物資源ゲノム解析センターの共同研究チームによる、日本固有の醸造用白ブドウ品種「甲州」のゲノム解析に関する研究が国際学術誌「Frontiers in Plant Science」に掲載されました。国際ブドウ・ワイン機構に2010年に登録されている「甲州ブドウ」は、主に山梨県で栽培されている日本固有の欧州系白ブドウ品種です(図1)。近年、これを原料とした「甲州ワイン」は、国際コンクールで受賞されるなど注目を集めています。特徴的なピンク色の果実の甲州ブドウを醸造した甲州白ワインは、柑橘系の香りと程よい酸味やわずかな渋みなど繊細な味わいを持ちますが、それらの特徴に影響を与えている「甲州ブドウ」の遺伝的な特徴は、これまで未解明のままでした。
そこで榎助教らは、東京農業大学との共同研究により、甲州の全ゲノム情報を初めて解読し、その他の醸造用ブドウ品種とゲノム情報を比較することで甲州の遺伝レベルでの特徴付けに成功しました。その結果、甲州の系統関係はその他の欧州系醸造用ブドウ約130種とは離れた独特なものでした(図2)。また赤ワイン用品種Tannatと食用や加工用にも使用される白ワイン用品種Thompson Seedlessと比較して、甲州は機能性が異なると推定される複数の遺伝子が発見されました(図3)。それらは、特にポリフェノールや柑橘系の香りに関係することが明らかになり、これまで言われているような甲州ブドウの特徴がゲノムレベルで科学的に裏付けられました。研究の成果は、甲州ワインの品質向上のための情報基盤となる他、ブドウの研究やワイン産業における甲州の遺伝資源としての利用促進への貢献が期待できます。
この研究成果は原著論文として国際学術誌「Frontiers in Plant Science」に11月5日付で掲載されました。電子版は既に公開されていますので、詳しくは学術誌ウェブページをご参照下さい。
「Genomic characterization of Japanese indigenous wine grape Vitis sp. cv. Koshu.」
Keisuke Tanaka, Yu Hamaguchi, Shunji Suzuki, Shinichi Enoki* (*責任著書).
(https://doi.org/10.3389/fpls.2020.532211)
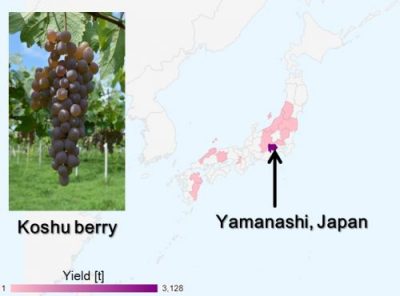
図1 日本固有の醸造用ブドウ品種「甲州」
主に山梨県で栽培されている、特徴的なピンク色の果実も持つ白ワイン用品種。柑橘系の香りと程よい酸味やわずかな渋みなど繊細な味わいの「甲州ワイン」ができる。
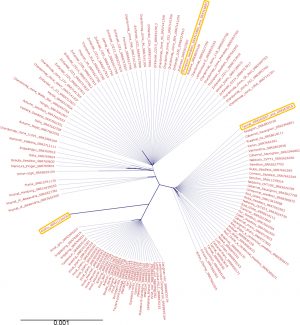
図2 甲州ブドウの系統樹
甲州と他の欧州系品種との全葉緑体ゲノムを比較した系統樹。欧州で有名な食用・白ワイン用品種の「Thompson Seedless」や赤ワイン用品種の「Tannat」などの他の品種と比べて「甲州」はどのグループにも属さないユニークな系統関係を示した。
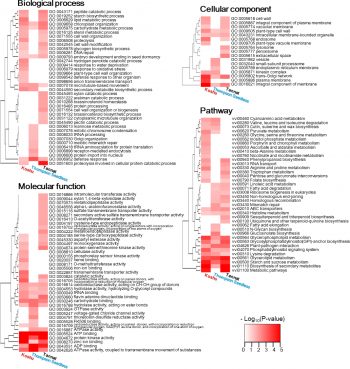
図3 甲州ゲノムの機能的特徴付け
各品種のゲノム比較により、甲州はポリフェノール生成に関するフェニルプロパノイド経路において、赤ブドウのような変異が見られるなどの特徴を示した。
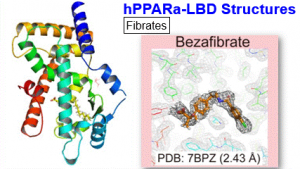
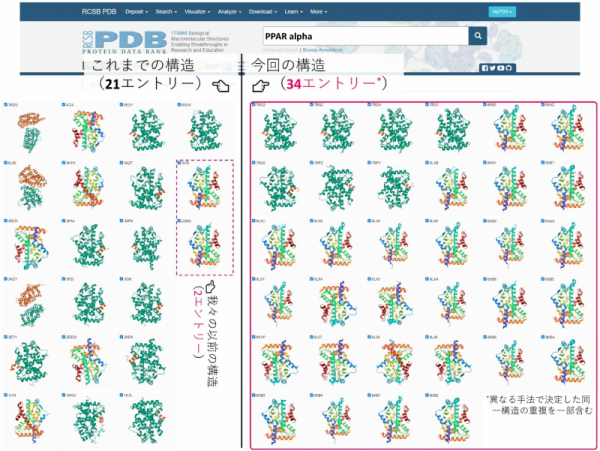
生命工学科大山拓次准教授と昭和薬科大学の共同研究チームが5年にわたって実施してきた脂質代謝に関わるタンパク質PPARαに関する研究が国際学術誌iScienceに掲載されました。高脂血症治療薬として用いられるフィブラート系薬は標的タンパク質不明のまま1960~1980年代にかけて開発されました。その後、脂質代謝に重要な主要転写因子・核内受容体PPAR (Peroxisome Proliferator-Activated Receptor)-αがターゲットであることが分かり、2001年に別化合物との複合体として初めてPPARα(リガンド結合ドメイン:LBD)の結晶構造が報告され、リガンド結合に伴うPPARα活性化の基本メカニズムが明らかとなりました。しかし、PPARαは全長はもちろんLBDのみでも結晶化が特に難しく、これまで21種類の結晶構造(21種類の化合物との複合体、そのうち2種類は大山准教授のグループ)しか報告されておらず、その中にフィブラートは含まれていません。つまり、全世界で何千万人の高脂血症患者が服用してきたフィブラート系薬の結合状態は未解明のままでした。
そこで大山准教授は、昭和薬科大学との共同研究により、臨床で使用される6種のフィブラート系薬や内因性活性化リガンドとして働きうる内在脂肪酸などがPPARαLBDに結合している良質の結晶を、オーソドックスな共結晶法を始めとして、浸漬法(Soaking)、シーディング法(Seeding)、脱脂法(delipidation)など様々な手法を駆使して作成し、過去の全報告数を上回る34種の結晶構造(別手法により決定した同一構造の重複を一部含む)を、かつてない高解像度のX線構造解析にて一度に明らかにしました。ボランティア学生を対象とした採血検査などの生化学解析も行い、主要内在脂肪酸(パルミチン酸とステアリン酸)が天然リガンドとなることを示しました。現在PPARファミリー(α、γ、δ)は代謝関連疾患の創薬標的として注目されており、本研究の成果は今後大きな波及効果を生むと期待されます。
この研究成果は原著論文として国際学術誌iScienceに11月20日付で掲載されます。電子版は既に公開されていますので、詳しくは学術誌ウェブページをご参照下さい。
DOI: https://doi.org/10.1016/j.isci.2020.101727