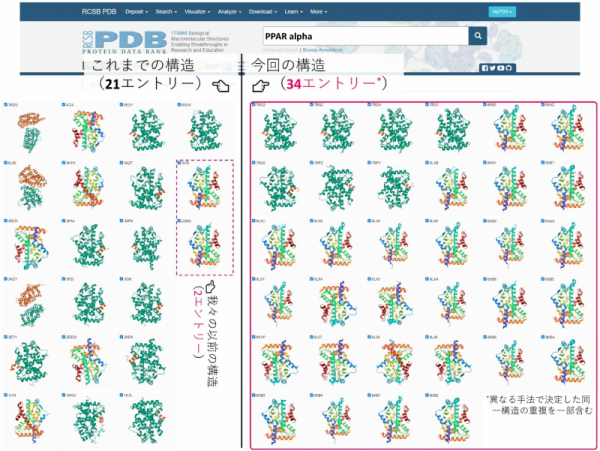
生命工学科大山拓次准教授と昭和薬科大学の共同研究チームが5年にわたって実施してきた脂質代謝に関わるタンパク質PPARαに関する研究が国際学術誌iScienceに掲載されました。高脂血症治療薬として用いられるフィブラート系薬は標的タンパク質不明のまま1960~1980年代にかけて開発されました。その後、脂質代謝に重要な主要転写因子・核内受容体PPAR (Peroxisome Proliferator-Activated Receptor)-αがターゲットであることが分かり、2001年に別化合物との複合体として初めてPPARα(リガンド結合ドメイン:LBD)の結晶構造が報告され、リガンド結合に伴うPPARα活性化の基本メカニズムが明らかとなりました。しかし、PPARαは全長はもちろんLBDのみでも結晶化が特に難しく、これまで21種類の結晶構造(21種類の化合物との複合体、そのうち2種類は大山准教授のグループ)しか報告されておらず、その中にフィブラートは含まれていません。つまり、全世界で何千万人の高脂血症患者が服用してきたフィブラート系薬の結合状態は未解明のままでした。
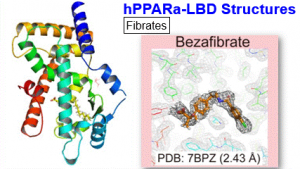
そこで大山准教授は、昭和薬科大学との共同研究により、臨床で使用される6種のフィブラート系薬や内因性活性化リガンドとして働きうる内在脂肪酸などがPPARαLBDに結合している良質の結晶を、オーソドックスな共結晶法を始めとして、浸漬法(Soaking)、シーディング法(Seeding)、脱脂法(delipidation)など様々な手法を駆使して作成し、過去の全報告数を上回る34種の結晶構造(別手法により決定した同一構造の重複を一部含む)を、かつてない高解像度のX線構造解析にて一度に明らかにしました。ボランティア学生を対象とした採血検査などの生化学解析も行い、主要内在脂肪酸(パルミチン酸とステアリン酸)が天然リガンドとなることを示しました。現在PPARファミリー(α、γ、δ)は代謝関連疾患の創薬標的として注目されており、本研究の成果は今後大きな波及効果を生むと期待されます。
この研究成果は原著論文として国際学術誌iScienceに11月20日付で掲載されます。電子版は既に公開されていますので、詳しくは学術誌ウェブページをご参照下さい。
DOI: https://doi.org/10.1016/j.isci.2020.101727